General: 932 850 010
Urgencias: 932 850 777

El Laboratorio de análisis clínicos está gestionado por Cerba Internacional y ofrece, tanto el servicio propio del ámbito hospitalario, atendiendo las solicitudes de todos los servicios y especialidades del la Clínica, como servicio ambulatorio a pacientes externos.
Está situado en la planta 1ª.
La unidad de Asistencia Continuada (urgencias), está disponible 24 horas al día, los 365 días del año, e incluye también el Servicio Transfusional.
Se dispone de concierto con la mayoría de compañías aseguradoras y no es necesaria cita previa para las analíticas convencionales.
El centro está dotado de medios suficientes para la realización de todas las magnitudes biológicas, tanto urgentes com rutinarias. Además, cuenta con el apoyo de nueve laboratorios de referencia propios, que permiten dar cobertura y respuesta a cualquier necesidad en los sigüientes ámbitos:
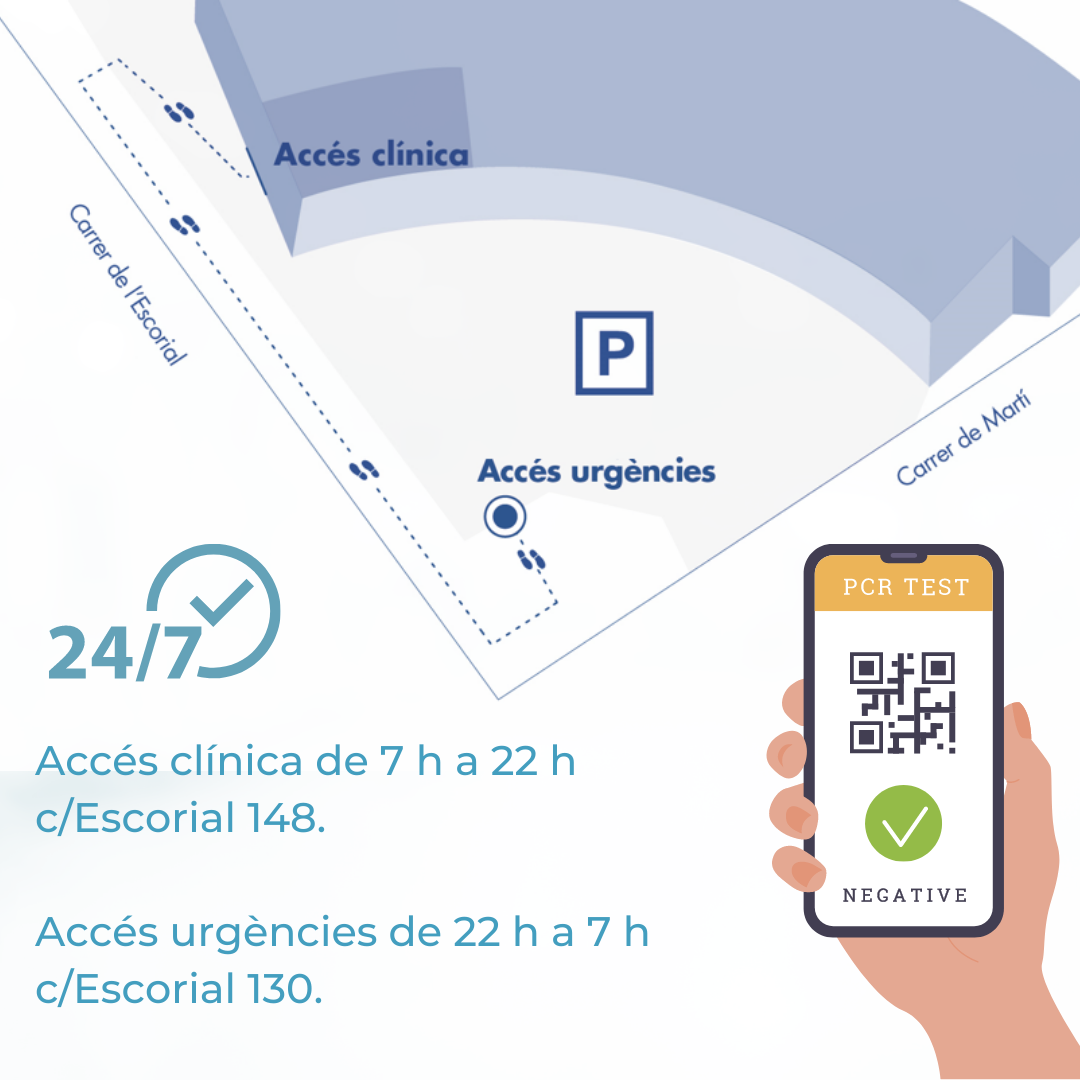
Para ayudarte cuando más lo necesites y ofrecerte el servicio más eficiente, hemos habilitado en nuestra Área de Analíticas de Asistencia Continuada 24 horas, las pruebas de detección del virus COVID-19.
El equipo de Cerba Clínica de Remei se adapta a todas las situaciones que se te puedan plantear y estamos disponibles las 24 horas en el día, los 7 días de la semana, tanto por el servicio de Analíticas convencional, como para realizar cualquier prueba de detección del virus SARS-COV-2.
Podéis programaros en nuestra citación en línea seleccionando centro Clínica de Remei, llamar al 93 720 26 11 o venir sin cita previa, aunque recomendamos programar la cita por alguna de las anteriores vías.
El resultado del test de detección ARN SARS-COV-2 (PCR) (COVID-19) estará disponible a las 24 horas, 8 horas o 2 horas con la nueva PCR EXPRESS y el test de detección rápida de antigeno SARS-COV-2 (COVID-19) en 20 minutos.
Os explicamos los tipos, las diferencias y las recomendaciones sobre las pruebas para la detección del SARS-CoV-2
Actualmente en nuestro laboratorio estamos disponibles y abiertos las 24 horas del día, los 7 días de la semana para realizar las diversas pruebas para la detección del virus:
La PCR (Reacción en cadena de la polimerasa) es la prueba de referencia puesto que su fiabilidad es prácticamente del 100% con un periodo de ventana muy corto.
Detecta la presencia de material genético del virus y se realiza a partir de una muestra respiratoria presa con un hisopo, obteniendo el resultado en 24h.
Ante un resultado positivo se considera que un individuo es potencialmente contagioso y continuará siendo así hasta que la PCR sea negativa.
Precios:
Entendemos la gran necesidad de agilidad al obtener un resultado negativo de COVID-19 para continuar con nuestros planes de vida en muchas ocasiones.
Por este motivo y ,para poder ofreceros una mejor gestión de vuestro tiempo, añadimos a nuestras opciones habituales (24 horas y 8 horas) la nueva PCR Express.
El test rápido de antígenos se realiza también con una muestra respiratoria y detectan la presencia de partículas estructurales del virus.
La sensibilidad más grande se da en los primeros días en los cuales se presentan síntomas, que es cuando la carga viral es más alta o aproximadamente 3-4 días después del posible contagio en el caso de los pacientes asintomáticos.
De manera general, esta prueba se recomienda en personas que presentan síntomas, para confirmar una infección por el virus. No es recomendable según las autoridades sanitarias su uso en personas asintomáticas.
Si la persona es asintomática un resultado negativo no confirma la ausencia del virus, de forma que ante este resultado sería recomendable realizar una PCR.
El ensayo CLIA detecta la presencia de anticuerpos IgM y IgG en suero del paciente enfrente la proteína S (o espícula) del coronavirus SARS-CoV-2.
La sensibilidad más grande se da en los primeros días en los cuales se presentan síntomas, que es cuando la carga viral es más alta o aproximadamente 3-4 días después del posible contagio en el caso de los pacientes asintomáticos.
A diferencia del anterior nos ofrece un resultado numérico (cuantitativo).
Dependiendo de la combinación de resultados nos da información diferente:
- o IgG negativa/IgM negativa, el individuo aparentemente puede no haber estado en contacto con el virus, de forma que de tener algún tipo de síntomas no sería debido a su presencia. Ahora bien, existe un periodo inicial en que los anticuerpos no se detectan de aproximadamente entre 7-8 días desde la infección en que estos anticuerpos también son negativos. Es por eso que esta prueba no sirve para descartar infecciones iniciales.
- o IgG negativa o positiva /IgM positiva, el individuo se encuentra en una fase inicial de la enfermedad y sería conveniente confirmarlo mediante una PCR.
- o IgG positiva / IgM negativa, el individuo ha pasado la infección y ha desarrollado anticuerpos contra la enfermedad. Según algunos estudios estos anticuerpos no garantizan que no haya una nueva infección , pero si que indican que la enfermedad se ha superado.
Únicamente se tiene que tener en cuenta los resultados que se emiten como indeterminados, que son resultados que se encuentran en la estrecha franja que existe entre el negativo y el positivo. En estos casos la sintomatología es la que nos da las pautas en el caso de la IgM:
1) Pacientes sintomáticos tienen que realizar una PCR para descartar la presencia del virus.
2) Pacientes asintomáticos tienen que realizar de nuevo la serología pasados 10-15 días para ver la evolución del título.
Esta prueba permite la detección de los anticuerpos anti diversa proteínas de la estructura del virus Sars-*Cov-2 en 24 horas.
Se usa para saber si hemos tenido una infección reciente o anterior, o por el contrario, solo presentamos la inmunidad adquirida por la vacunación contra el virus.
En personas que hayan pasado de manera natural la infección, en la mayoría de los casos, nos encontraremos que presentan anticuerpos ante la proteína N (así como posiblement también en frente de los otros epitops).
De forma que un resultado positivo por anticuerpos anti proteína N, nos permite detectar si el paciente realmente ha pasado en los últimos meses de manera natural por medio del contacto directo con el virus.
El resultado se obtiene en 24 horas y su precio es de 25€.
Control puesto vacunación
Permite detectar exclusivamente anticuerpos del tipo IgG anti las proteínes S1 y S2 del virus, que son los anticuerpos que aparecen cuando nos vacunamos.
Con esta prueba proporcionamos tanto un resultado cuantitativo como cualitativo, de forma que permite facilitar el estudio del estado inmunitari de los pacientes que se han vacunado, proporcionando un indicador de la presencia de anticosos IgG neutralizantes contra el SARS-CoV-2.
Para ayudarte cuando más lo necesites y ofrecerte el servicio más eficiente, hemos habilitado en nuestra Área de Analíticas de Asistencia Continuada 24 horas, las pruebas de detección del virus COVID-19.
El equipo de Cerba Clínica de Remei se adapta a todas las situaciones que se te puedan plantear y estamos disponibles las 24 horas en el día, los 7 días de la semana, tanto por el servicio de Analíticas convencional, como para realizar cualquier prueba de detección del virus SARS-COV-2.
Podéis programaros en nuestra citación en línea seleccionando centro Clínica de Remei, llamar al 93 720 26 11 o venir sin cita previa, aunque recomendamos programar la cita por alguna de las anteriores vías.
Si tenéis cualquier duda, podéis llamar al 93 720 26 11 o enviando un correo a remei@cerba.com.
La detección de la expresión del gen PCA3 distingue las células cancerígenas de próstata
El cáncer de próstata es uno de los tumores más frecuentes diagnosticados en hombres y, en las fases iniciales de la enfermedad, la mayoría de los hombres con cáncer de próstata son asintomáticos. La detección precoz del cáncer de próstata es fundamental porque la posibilidad de curación se acerca al 100% si se detecta precozmente.
Las formas habituales de cribado son la determinación del marcador tumoral PSA (antígeno prostático específico), el tacto rectal y las pruebas de imagen, como indicadores para la realización de una biopsia prostática, la cual posibilita la confirmación del diagnóstico. Pero el PSA no es del todo específico, ya que también puede verse alterado por agrandamiento o infección de la próstata.
El gen PCA3 (Prostate Cancer Antigen 3 Gene) es el primer gen específico de próstata capaz de mostrar una sobreexpresión en células prostáticas tumorales. En las células cancerígenas de la próstata se detecta de 60 a 100 veces más ARN mensajero (ARNm) del gen PCA3 que en células prostáticas normales.
El Estudio Genético de Expresión de PCA3 es específico de cáncer de próstata y permite una detección precoz.
En la expresión del PCA3 Gen no intervienen condiciones como el agrandamiento de la próstata o enfermedades benignas o no cancerosas de la próstata. Es específica de células tumorales.
Un estudio recomendado a hombres:
Esta prueba genética complementa la prueba del PSA (antígeno prostático específico).
Prueba: 8802 - EXPRESION DEL GEN PCA3 (CÁNCER PRÓSTATA), ORINA
Metodología: Amplificación mediada por Transcripción seguida por Hibridación
Requisitos: Petición médica y consentimiento informado firmado
Tipo de muestra: 5 mL orina obtenida postacto rectal. Recogida en tubo de transporte especial. Mantener refrigerada.
Preparación previa: Requiere que el paciente beba medio litro de agua, más tacto rectal previo. Solicitar las instrucciones de recogida de muestra
Plazo de entrega: 20 días laborables
Ante un nivel de PSA elevado y otras pruebas diagnósticas que hacen sospechar la presencia de cáncer de próstata, está recomendada la realización de una biopsia que consiste en la extracción de células o tejidos para el análisis anatomopatológico.
Dado que una biopsia siempre comporta algún riesgo como una infección o hemorragia y dolor, es importante tener la máxima información para que el médico pueda decidir si realmente existe la necesidad de realizar una biopsia de próstata ante la sospecha de cáncer.
El Estudio detecta la presencia de ARN mensajero de este gen en orina. Esto indica que el gen se está expresando, cosa que sucede en células cancerosas de próstata.
Los resultados deben ser interpretados por el urólogo
El test PCA3 requiere la obtención de orina recogida después del examen de la próstata mediante tacto rectal. El tacto rectal libera las células de la próstata a través del sistema de conductos de la próstata al tracto urinario, donde se eliminan con la primera micción de orina. La orina se recoge en el tubo de transporte con el agregado del Medio de Transporte Especial que disuelve las células y estabiliza el ARN mensajero. Los ARNm de PCA3 y PSA se cuantifican y se obtiene su cociente.
Los cocientes (ARNm PCA3 / ARNm PSA) elevados se correlacionan con una alta probabilidad de que una biopsia de próstata sea positiva. El punto de corte recomendado es de 35.
Los hombres con un resultado igual o superior a 35 tienen alta probabilidad de cáncer de próstata.
Los hombres con un resultado inferior a 35 tienen baja probabilidad de cáncer de próstata.
El test PCA3 es específico del cáncer de próstata y sus valores no están afectados por el tamaño de la próstata ni por la hiperplasia benigna de próstata.
No se debe realizar esta prueba a los pacientes que están tomando medicamentos que afectan los valores de PSA como puede ser: finasterida (Proscar, Propecia), dutasterida (Avodart) y terapia de antiandrógenos (Lupron).
La prostatectomía, radiación y biopsia de próstata pueden afectar la viabilidad del tejido prostático e influir en los resultados del PCA3.
|
Valor de PCA3 |
<5 |
5 - 9 |
10 – 19 |
20 – 34 |
35 - 49 |
50 - 100 |
|
Sensibilidad (%) |
96 % |
85 % |
77 % |
63 % |
53 % |
41 % |
|
Especificidad (%) |
14 % |
33 % |
47 % |
61 % |
74 % |
84 % |
Medición cuantitativa de hormona antimulleriana (AMH)
AMH: Información sobre la reserva ovárica
La mujer nace con una reserva aproximada de un millón de ovocitos (célula germinal femenina que se convertirá en óvulo maduro). En la pubertad, esta cantidad se reduce casi a la mitad y va disminuyendo hasta la llegada de la menopausia. Asimismo, los niveles séricos de AMH alcanzan los niveles máximos después de la pubertad y disminuyen lentamente a lo largo de la vida, convirtiéndose en indetectables en la menopausia.
En la mujer, la AMH juega un papel fundamental en la foliculogénesis y refleja el número de folículos antrales y preantrales. Los niveles séricos de AMH correlacionan con el número de folículos primordiales en los ovarios y permiten determinar de manera fiable el potencial de fertilidad.
La concentración de AMH permite evaluar la reserva ovárica de la mujer o, lo que es lo mismo, su capacidad para producir óvulos fértiles.
Prueba: 15581- HORMONA ANTIMULLERIANA, SUERO
Metodología según la prueba solicitada por el médico: Inmunoensayo de electroquimioluminiscencia (ECLIA)
Tipo de muestra: Suero o plasma heparina litio refrigerado. No emplear plasma con EDTA.
Preparación previa: No se necesita ninguna preparación especial. Se puede realizar en cualquier día del ciclo menstrual.
Plazo de entrega: 3 días.
Concordancia entre el Recuento de Folículos Antrales (RFA) y los niveles séricos de AMH:
RFA 0-7 RFA 8-15 RFA >15
AMH ≤ 4.86 pmol/L 63.2% 32.4% 4.4%
(0.681 ng/mL)
AMH 4.87-16.2 pmol/L 12% 56.9% 31.1%
(0.682 ng/mL-2.27 ng/mL)
AMH >16.2 pmol/L 1.4% 24.1% 74.5%
(>2.27 ng/mL)
Para pacientes con valores de AMH ≤ 4.86 pmol/L (0.681 ng/mL), la probabilidad de valores bajos de RFA (0-7) es del 63 %, la probabilidad de encontrarse en el grupo medio de RFA (8-15) es de alrededor del 32 % y la probabilidad de encontrarse en el grupo de RFA > 15 del 4.4 % solamente.
Para pacientes con valores altos de AMH (> 16.2 pmol/L; 2.27 ng/mL), la probabilidad de valores de RFA > 15 es del 75 %, la probabilidad de encontrarse en el grupo medio de RFA (8-15) es del 24 % y solamente el 1.4 % tiene una probabilidad de RFA< 8
pmol/L ng/mL
Hombres 10,20-82,80 1,43-11,60
Mujeres 20-24 Años 10,90-71,00 1,52-9,95
Mujeres 25-29 Años 8,57-64,60 1,20-9,05
Mujeres 30-34 Años 5,08-54,20 0,71-7,59
Mujeres 35-39 Años 2,89-49,70 0,41-6,96
Mujeres 40-44 Años 0,42-31,70 0,06-4,44
Mujeres 45-50 Años 0,07-12,80 0,01-1,79
Respuesta a estimulación ovárica ALTA > 15,00 > 2,10
Síndrome de Ovarios Poliquísticos 17,20-122,00 2,41-17,10
Conocer si existe predisposición genética a sufrir cáncer
El mayor y mejor conocimiento de las bases genéticas y moleculares del cáncer, así como nuevas técnicas de imagen y de laboratorio cada más sensibles, permiten realizar una medicina preventiva, capaz de identificar a los individuos con alto riesgo a desarrollar ciertos tipos de tumores y de mejorar el pronóstico a largo plazo.
El consejo genético tiene cada vez mayor demanda: en base a la información, los riesgos y beneficios de diferentes opciones se pueden tomar las mejores medidas para la detección precoz y la disminución del riesgo, así como para disminuir la ansiedad personal y familiar.
El cáncer de mama es la neoplasia más frecuente en la mujer, con una prevalencia en los países occidentales de unos 40 casos/100.000/año y con una media de edad de 60 años al momento del diagnóstico. Aunque puede existir una historia familiar de cáncer de mama, la mayoría de casos son de origen esporádico (70 %), una pequeña proporción son casos de agregación familiar (20 - 25 %) y sólo una minoría de casos tienen un carácter hereditario (5 - 10 %).
Por todo ello, un antecedente familiar de cáncer de mama no implica obligatoriamente la presencia de una mutación genética hereditaria de predisposición al cáncer de mama.
Alteraciones en los genes BRCA1 y BRCA2 indican un riesgo para desarrollar cáncer de mama y ovario,pero también de próstata, páncreas y melanoma
Un estudio recomendado a hombres y mujeres
Las guías de la National Comprehensive Cancer Network 2015, recomiendan realizar el estudio genético de BRCA1 y BRCA2; en los individuos que cumplen 1 o más de los siguientes criterios:
1) Familia con una mutación conocida en los genes BRCA1/BRCA2
2) Historia personal de cáncer con 1 o más de los siguientes puntos
- Cáncer de mama primario adicional (contralateral o ipsilateral)
- ≥ 1 familiar de primer, segundo o tercer nivel con cáncer de mama a cualquier edad
- ≥ 1 de primer, segundo o tercer grado con cáncer de mama diagnosticado ≤ 50 años
- ≥ 2 familiares de primer, segundo o tercer grado con cáncer de mama a cualquier edad
- ≥ 1 familiar con cáncer de ovario invasivo
- ≥ 2 familiares de primer, segundo o tercer grado con cáncer de páncreas y/o de próstata (score Gleason ≥ 7) a cualquier edad
. - 1 familiar varón de primer, segundo o tercer grado con cáncer de mama
- Individuos judíos Ashkenazis por presentar una mayor frecuencia de mutación
3) Historia personal de cáncer de ovario invasivo
4) Historia personal de cáncer de mama en varón
5) 3 o más familiares de primer grado, afectados de cáncer de mama y/o ovario
6) Dos casos entre familiares de primer o segundo grado, afectados de cáncer de mama y/o ovario. Con un caso familiar menor de 50 años con cáncer de mama
|
Mutaciones en Gen BRCA1 Localizado en el cromosoma 17q21
|
Mujeres: hasta 80% más de riesgo de cáncer de mama y ovario, mayor riesgo para cáncer de páncreas. Hombres: hasta 20% más de riesgo de cáncer de mama, mayor riesgo para cáncer de páncreas y de próstata. |
|
Mutaciones en Gen BRCA2 Localizado en el cromosoma 13q12-13
|
Mujeres: hasta 80% más de riesgo de cáncer de mama y hasta 27% más de riesgo de cáncer de ovario. Hombres: aumento del riesgo de cáncer de mama masculino (8,9 %) y cáncer de próstata, páncreas y melanoma. |
|
Pruebas |
15446 - Cáncer de mama y ovario hereditarios (BRCA1 y BRCA2) por NGS |
|
|
10925 - Cáncer de mama y ovario hereditarios (BRCA1) por MLPA |
|
|
10927 - Cáncer de mama y ovario hereditarios (BRCA2) por MLPA |
|
|
10926 - Cáncer de mama y ovario hereditarios (BRCA1) mutación conocida |
|
|
10928 - Cáncer de mama y ovario hereditarios (BRCA2) mutación conocida |
|
Metodología |
Secuenciación masiva (NGS) para detectar mutaciones y MLPA (multiplex ligation-dependent probe amplification) para detectar grandes deleciones y duplicaciones |
|
Requisitos y documentos |
- Prescripción médica - Historia clínica resumida - Copia del resultado del estudio genético del caso índice familiar (si disponible) - Documento de consentimiento informado del paciente |
|
Tipo de muestra |
Muestra de sangre EDTA (2-8 ºC - Refrigerar) |
|
Preparación previa |
No se requiere ayuno ni preparación previa |
|
Plazo de entrega
|
30-60 días, según las técnicas empleadas |
Alteraciones en los genes BRCA1 y BRCA2 indican un riesgo acumulado mayor a lo largo de la vida, para desarrollar cáncer de mama y ovario; pero también de próstata, páncreas y melanoma. Las portadoras de una mutación en la línea germinal en los genes BRCA1 y BRCA2 tienen un riesgo de cáncer de mama a lo largo de la vida del 46-87% y 38-84 %, respectivamente y de cáncer de ovario del 39-63 % y 16,5-27 %, respectivamente.
El planteamiento del estudio molecular siempre ha de incluir el análisis de los dos genes BRCA1 y BRCA2 (salvo que exista una mutación familiar previamente conocida y estudiada en uno de los dos genes) puesto que ambos están asociados con un alto riesgo de cáncer de mama y ovario. En caso de encontrar una mutación en un individuo, el informe aporta un asesoramiento genético resumido que debe ser ampliado por el médico solicitante y esta mutación es la que debe ser estudiada en los familiares de riesgo.
Preeclampsia: una complicación grave en el 3-5 % de los embarazos
Test predictivo/diagnóstico
La preeclampsia es un síndrome que puede ocurrir a partir de las 20 semanas de embarazo, debido probablemente a una alteración del flujo sanguíneo materno útero-placentario. Es una de las principales causas de morbilidad y mortalidad materna y perinatal. Su única cura es el nacimiento del bebé.
La preeclampsia se caracteriza por:
Mujeres con hipertensión crónica y enfermedades médicas previas al embarazo, requieren vigilancia y seguimiento médico especial. Gracias al Estudio de Preeclampsia, es posible el diagnóstico de la existencia de preeclampsia o del riesgo de desarrollarla en las próximas semanas.
Una prueba recomendada a mujeres embarazadas que tienen factores de riesgo:
El test: Información confirmatoria o predictiva, para que el médico actúe a tiempo
Diagnóstico confirmatorio: evidencia del síndrome, valoración de la gravedad y progresión; permitiendo una rápida actuación médica a favor de la paciente y el bebé.
Predicción:
La medición del ratio con Elecsys sFI-1/PFIG es una herramienta fiable en mujeres con sospecha de preeclampsia para identificar a aquellas pacientes con alto riesgo de desarrollar preeclampsia en las próximas 4 semanas y que requieren una vigilancia más estrecha. Por otro lado, los tests para la medición del ratio Elecsys sFIt-1/PIGF permiten enviar a casa con seguridad a aquellas mujeres con sospecha de preeclampsia que no van a desarrollar la enfermedad en una semana.
El ratio sFIt-PIGF sirve para diferenciar preeclampsia/HELLP de diferentes formas de trastornos hipertensivos del embarazo.
sFIt-1/PIGF >= 85 Diagnóstico La mujer tiene preeclampsia. Especificidad 99.5 %
sFIt-1/PIGF <85 >=38 Predicción: Inclusión en próximas 4 semanas Alto riesgo de desarrollar preeclampsia en las próximas 4 semanas. Valor Predictivo Positivo: 38.6 %
sFIt-1/PIGF <38 Predicción: Descarte en la próxima semana La mujer no desarrollará preeclampsia en la próxima semana. Valor Predictivo Negativo: 99.1 %
sFIt-1/PIGF >= 110 Diagnóstico: La mujer tiene preeclampsia. Especificidad 95.5 %
sFIt-1/PIGF <110 >=38 Predicción: Inclusión en próximas 4 semanas Alto riesgo de desarrollar preeclampsia en las próximas 4 semanas. Valor Predictivo Positivo: 38.6 %
sFIt-1/PIGF <38 Predicción: Descarte en la próxima semana, La mujer no desarrollará preeclampsia en la próxima semana. Valor Predictivo Negativo: 99.1 %
Pruebas: 2578- TEST PREDICTIVO/ DIÁGNOSTICO DE PREECLAMPSIA, SUERO
Requisitos: Realizar examen después de la semana 20 de gestación
Tipo de muestra: Suero refrigerado
Preparación previa: No es necesario el ayuno
Metodología según la prueba solicitada por el médico:
Medición del ratio sFlt-1/PIGF. Inmunoensayo de electroquimioluminiscencia
Plazo de entrega: 2 días
El gluten es una proteína que se encuentra en la semilla de cereales como el trigo, la cebada, la avena y el centeno, entre otros.
La enfermedad celíaca (EC) o celiaquía es una enfermedad autoinmune que se caracteriza por la intolerancia al gluten. Las enfermedades autoinmunes se producen cuando nuestro sistema inmunológico, que normalmente se ocupa de defendernos frente a agentes infecciosos, reacciona contra células propias. En el caso de la celiaquía, cuando el gluten está presente en la dieta de las personas genéticamente susceptibles a esta enfermedad, se producen auto-anticuerpos que actúan en el intestino y causan atrofia de las vellosidades intestinales, malabsorción y malnutrición.
Los síntomas más frecuentes de la celiaquía son: pérdida de peso, pérdida de apetito, fatiga, náuseas, vómitos, diarrea, distensión abdominal, pérdida de masa muscular, retraso del crecimiento, irritabilidad, apatía, dolores abdominales, meteorismo. Sin embargo, tanto en el niño como en el adulto, los síntomas pueden ser atípicos o estar ausentes, dificultando el diagnóstico. Actualmente se reconoce que hay distintos tipos de celiaquía:
El tratamiento de la enfermedad celiaca consiste en el seguimiento de una dieta estricta sin gluten durante toda la vida.
Un estudio recomendado para:
Prueba: 8826- HLA DQ2/DQ8 (CELIAQUIA), SANGRE
Metodología: Análisis molecular por PCR-SSO
Requisitos: Petición médica y consentimiento informado firmado
Tipo de muestra: 5 mL de sangre EDTA
Preparación previa: No se requiere
Plazo de entrega: 7 días
El diagnóstico se realiza en base a los síntomas, historia clínica, pruebas de serología, biopsia intestinal y pruebas genéticas. Existen marcadores de susceptibilidad genética a la enfermedad celiaca: el haplotipo DQ2 y adicionalmente el DQ8.
El sistema HLA interviene en la respuesta inmune, que normalmente está dirigida al desarrollo de reacciones frente a agentes infecciosos. En patologías autoinmunes la diana de la respuesta son los tejidos propios.
Los genes que codifican las moléculas HLA se encuentran reunidos en un fragmento del brazo corto del cromosoma 6. El sistema HLA presenta un elevado polimorfismo en forma de variantes alélicas (genes funcionales con pequeñas variaciones en su estructura) entre diferentes individuos.
El estudio analiza las variantes alélicas HLA. Primero se realiza la extracción del ADN de la muestra de sangre, luego se amplifican las regiones específicas mediante una reacción en cadena de la polimerasa y se analizan mediante sondas oligonucleicas específicas de los alelos (PCR-SSO).
Según la Sociedad Europea de Gastroenterología Pediátrica, Hepatología y Nutrición, la Enfermedad Celiaca (EC) o Celiaquía es una enfermedad sistémica inmunomediada, provocada por el gluten y prolaminas relacionadas, en individuos genéticamente susceptibles. Se caracteriza por la presencia de una combinación variable de: manifestaciones clínicas dependientes del gluten, anticuerpos específicos de EC, haplotipos HLA DQ2 o DQ8 y enteropatía.
Los estudios científicos han puesto en evidencia que el 90-95% de los pacientes con enfermedad celiaca presentan el heterodímero HLA DQ2, que está codificado por los alelos DQA1*0501 y DQB1*0201 en cis o por los alelos DQA1*0505 y DQB1*0202 en trans.
El 5-10% de los pacientes restantes presentan mayoritariamente un segundo heterodímero de riesgo, el HLA DQ8, codificado por los alelos DQA1*03 y DQB1*0302.
El estudio genético de la Celiaquía tiene un alto valor predictivo negativo, de tal manera que no poseer los 4 alelos del HLA DQ2 y DQ8 permite excluir la enfermedad celiaca con un 99% de certeza.
Aproximadamente el 30% de la población tiene alelos asociados a enfermedad celiaca pero sólo el 3% desarrolla la enfermedad. La presencia de estos haplotipos es necesaria pero no suficiente para causar enfermedad celiaca.
Estudiando el genoma de la persona, esta prueba permite obtener una clasificación del riesgo genético de hipertensión y episodios cardiovasculares asociados, que es útil en la evaluación clínica y la prevención en etapas tempranas.
La hipertensión arterial (HTA) es una enfermedad crónica caracterizada por un incremento de las cifras de la presión sanguínea por encima de los límites normales. Cerca de un tercio de la población adulta sufre de hipertensión arterial.
La hipertensión crónica causa complicaciones graves si no se trata a tiempo. Es el factor de riesgo modificable más importante para desarrollar enfermedades cardiovasculares, así como para la enfermedad cerebrovascular y renal.
En el 90 % de los casos la causa de la HTA es desconocida, por lo cual se denomina «hipertensión arterial esencial», y tiene una fuerte influencia hereditaria. El riesgo genético tiene un efecto acumulativo sobre el riesgo ambiental en el establecimiento de la hipertensión arterial.
El Estudio Genético de la Hipertensión Arterial es una prueba genética que se basa en el enfoque innovador de la Medicina Personalizada, teniendo en cuenta las diferencias genéticas, ambientales y de estilo de vida de cada individuo, con el fin de prevenir y tratar la hipertensión arterial.
El estudio incluye Farmacogenética: analiza el efecto de la variabilidad genética de la persona en su respuesta a determinados fármacos. De este modo puede recomendar el tratamiento anti-hipertensivo más eficaz.
Estudio de marcadores moleculares de la hipertensión esencial y de los eventos cardiovasculares asociados. Estudio farmacogenético de la terapia antihipertensiva.
Un estudio recomendado a personas con …
Antecedentes personales o familiares de hipertensión arterial
Enfermedad cardiovascular
Preeclampsia, hipertensión gestacional, restricción del crecimiento intrauterino
Factores de riesgo ambiental como son: dieta rica en sal, comida rápida, vida sedentaria, tabaquismo, alcoholismo crónico, estrés o ansiedad
Prueba: 15694 - ESTUDIO GENETICO DE HIPERTENSION ARTERIAL
Metodología: Extracción del ADN a partir de sangre. Análisis de 57 variantes en 37 genes
Requisitos: Se requiere firmar el consentimiento informado y rellenar un cuestionario
Tipo de muestra: Sangre total en tubo EDTA
Preparación previa: No es necesaria
Plazo de entrega: 3 - 4 semanas a partir de la recepción de la muestra
Se estudian 57 variantes genéticas localizadas en 37 genes que se asocian a un alto riesgo de predisposición a la hipertensión arterial y eventos cardiovasculares asociados.
Se evalúan las variantes genéticas que están relacionadas con:
1) El sistema renina-angiotensina-aldosterona;
2) La disfunción endotelial del sistema vascular;
3) El asa de Henle/el túbulo renal;
4) El sistema de transducción de señales;
5) Los canales de sodio
6) El sistema nervioso autónomo.
Además se estudian algunas de las variantes genéticas que modulan la respuesta a algunos fármacos antihipertensivos.
El informe final consta de:
La trombofilia es una anomalía de la coagulación que aumenta el riesgo de trombosis o formación de coágulos sanguíneos
La trombofilia puede ser hereditaria o adquirida, ya que tanto los factores genéticos como los ambientales influyen sobre la coagulación.
Las trombofilias hereditarias tienen una prevalencia del 10% en todo el mundo. Pueden ser totalmente asintomáticas, pero se asocian a un mayor riesgo de trombosis tanto en hombres como en mujeres.
El riesgo de trombosis en mujeres aumenta durante el embarazo y el puerperio, durante la toma de anticonceptivos orales que contengan estrógenos, con el uso de hormonas que se usan en la estimulación ovárica en los tratamientos de fertilización asistida y con el uso de terapia de reemplazo hormonal durante la menopausia.
Las consecuencias de la trombosis pueden ser enfermedades como la enfermedad vascular tromboembólica, trombosis venosa profunda, embolia pulmonar y trombosis arterial. Además, las trombofilias se pueden asociar con mayor riesgo de complicaciones gestacionales como aborto temprano de menos de 10 semanas de gestación, muerte fetal intrauterina, parto prematuro, desprendimiento prematuro de placenta y preeclampsia.
Un estudio recomendado para personas con:
Prueba: 15695 - ESTUDIO GENETICO DE LA TROMBOFILIA HEREDITARIA
Metodología: Extracción del ADN a partir de sangre. Análisis de 14 variantes en 10 genes
Requisitos: Petición médica y consentimiento informado firmado
Tipo de muestra: 5 mL de sangre EDTA
Preparación previa: No se requiere
Plazo de entrega: 7 días
El estudio genético de la trombofilia hereditaria analiza las 14 variantes genéticas, en 10 genes distintos, que son consideradas como un factor de riesgo asociado a las trombofilias por causar una deficiencia de inhibidores naturales de la coagulación o bien por promover un aumento del nivel de los factores de coagulación. Los genes estudiados son: FII, FV, F13A, FGB, GP1BA, MTHFR, PAI1, PROCR, PROS1 y SERPINC1.
Este estudio permite:
Las trombofilias hereditarias se deben a alteraciones genéticas que:
El informe final consta de:
4. Bibliografía
Los pacientes con trombofilias hereditarias deben someterse a una evaluación del riesgo individual para la toma de decisiones clínicas apropiadas relativas al estilo de vida y al tratamiento farmacológico.
La trombofilia hereditaria es una enfermedad genética de transmisión familiar, por lo tanto, se recomienda el estudio de esta(s) variante(s) genética(s) en los familiares directos del portador. En esta situación, se recomienda una consulta médica de genética para la familia.
Los riesgos, beneficios y limitaciones de la prueba deben ser discutidos y explicados en el contexto de la heredabilidad y del riesgo de la enfermedad.
La migraña afecta a casi un 15% de la población y tiene importantes consecuencias en la vida personal y laboral.
Diferentes estudios científicos sitúan a la alimentación, y en concreto la ingesta de histamina, como una de las posibles causas de las migrañas.
El consumo de alimentos que contienen histamina no supone un problema en sí mismo, ya que en condiciones normales ésta es degradada y metabolizada por la enzima Diamino Oxidasa (DAO). El problema aparece cuando nuestro organismo es incapaz de metabolizarla causando efectos adversos, entre ellos el de la migraña.
Cuando existe una desproporción entre la histamina ingerida, o la liberada de las células que la almacenan en el organismo, y la capacidad de metabolización de la misma, se produce una acumulación en sangre y en consecuencia la aparición de efectos adversos.
La deficiencia de la enzima Diamino Oxidasa (DAO) aumenta el riesgo de sufrir migraña
Un estudio recomendado a personas que sufren migraña, para poder adecuar la alimentación en caso de detectarse un déficit de DAO:
Prueba: 10075 - DAO
Metodología: Enzimoinmunoanálisis
Tipo de muestra: Suero congelado
Preparación previa: No se requiere.
Plazo de entrega: 2 semanas
El test DAO estudia la actividad de la enzima Diamino Oxidasa en una muestra de sangre para determinar si es normal o presenta un déficit
Una disminución en la actividad de la DAO se traduce en un aumento del riesgo de sufrir los efectos adversos de la histamina, destacando por su carácter incapacitante la migraña.
Una disminución en la actividad de la DAO aumenta el riesgo de sufrir los efectos adversos de la acumulación de histamina, como la migraña entre otros.
La deficiencia de este enzima se puede tener diversos orígenes:
- Origen genético: Se han identificado polimorfismos genéticos asociados a este déficit.
- Origen patológico: A causa de enfermedades inflamatorias intestinales (colitis ulcerosa, enfermedad de Crohn...)
- Origen farmacológico: Por inhibición de la DAO por parte de diversos fármacos. Este riesgo es relativamente importante, ya que se han señalado del orden de 90 medicamentos capaces de inhibir la DAO.
Un déficit de DAO no se puede prevenir ni curar, pero con un tratamiento dietético eficaz del déficit, sí pueden prevenirse los síntomas que este trastorno metabólico desencadena, como la migraña o los trastornos digestivos como hinchazón, estreñimiento o diarrea.
A partir de una muestra de saliva, recomendaciones personalizadas basadas en los resultados genéticos
Con el aporte energético óptimo, tus objetivos más cerca
El siglo XXI es la era de la medicina personalizada, que comenzó gracias a los avances realizados por el Proyecto Genoma Humano (PGH) (1990 – 2003): a partir de la estructura genética de un individuo, es posible obtener información preventiva y diagnóstica para el mantenimiento de su salud.
También la Medicina del Deporte se complementa actualmente con estudios genéticos nutricionales, que indican cómo puede el deportista disponer de un aporte energético óptimo, que le permita mejorar su rendimiento y salud en general.
Si eres deportista profesional o amateur, necesitas una correcta ingesta de alimentos y líquidos que te aporten la energía e hidratación necesarias en cada momento. También necesitas conocer incompatibilidades alimenticias y el funcionamiento de tu metabolismo.
Gracias al Estudio Genético en Nutrición Deportiva, obtendrás información y recomendaciones útiles
Un estudio recomendado a…
Es fundamental que el deportista esté asesorado por un especialista o profesional, que utilice la información como herramienta complementaria; pudiendo tener en cuenta otras variables que influyen en el rendimiento del atleta.
Prueba: 15677- TEST GENETICO EN NUTRICION DEPORTIVA
Metodología: Extracción del ADN a partir de la saliva. Análisis de 25 SNPs en 22 genes.
Requisitos: Se requiere firmar el consentimiento informado y rellenar un cuestionario.
Tipo de muestra: Saliva
Preparación previa: No es necesaria
Plazo de entrega: 3 - 4 semanas a partir de la recepción de la muestra de saliva
La genética aporta información predictiva fiable y objetiva
La habilidad que presentan los músculos esqueléticos para producir fuerza a grandes velocidades, está fuertemente influenciada por la genética y sin un perfil genético adecuado; un deportista puede encontrar disminuidas sus opciones de rendimiento.
La información genética se combina con datos de nutrición y actividad personales, obtenidos a partir de un cuestionario, para la elaboración del informe final.
El estudio te proporciona información y recomendaciones útiles, para que realices una práctica deportiva acorde a tus objetivos y mejores tu alimentación, rendimiento y salud en general.
Se sabe que la influencia del genoma en la nutrición deportiva oscila entre un 15% y 20%, por tanto la información proporcionada indica predisposición o sensibilidad y por ello no es absoluta. En el Estudio Genético en Nutrición Deportiva se analizan 25 polimorfismos genéticos (SNPs), alteraciones de una sola base en la secuencia del material genético (ADN) en 22 genes.
El informe final consta de:
1. Introducción de conceptos genéticos básicos y que facilitan la comprensión de los resultados.
2. Resumen de los datos proporcionados por el deportista mediante el cuestionario.
3. Resultados genéticos: tabla en la que se muestra los genes analizados y la variante genética (polimorfismo) que presenta.
4. Resultados y explicación respecto a:
5. Propuesta semanal de dieta: alimentos y cantidades a ingerir durante 7 días, en 5 tomas/día
Sports Medicine Genomics es un laboratorio especializado en genética deportiva, aplicada al deporte profesional y amateur; en tres áreas fundamentales relacionadas con el rendimiento con el rendimiento: prevención de lesiones, nutrición y condición física.
Estudio de la inmunoglobulina G específica
Estudio de 216 alimentos y Estudio de 108 alimentos. Dos estudios de sensibilidad alimentaria para escoger
Un estudio recomendado para:
Prueba:
8330- ESTUDIO SUPERCOMPLETO DE SENSIBILIDAD ALIMENTARIA (216 ALIMENT
8331- ESTUDIO COMPLETO DE SENSIBILIDAD ALIMENTARIA (108 ALIMENTOS)
Metodología: Determinación de IgG específica
Requisitos: Si se desea recibir el informe en formato digital, se debe aportar correo electrónico y teléfono móvil.
Tipo de muestra: Suero refrigerado
Preparación previa: No es necesaria
Plazo de entrega: 5 días laborables
El informe proporciona los resultados cuantitativos individuales, para cada uno de los alimentos estudiados. Se clasifican las reacciones según su intensidad en:
Se proporcionan además recomendaciones y otras informaciones útiles. Sin embargo, los resultados no constituyen en sí mismos un diagnóstico completo y no deben tomarse como única base para un cambio fundamental en la dieta. En caso de reacciones positivas, acuda a un especialista cualificado.
Por favor recuerde que este ensayo no determina anticuerpos de tipo IgE, como los presentes en caso de alergia.
Tus objetivos más cerca : El valor predictivo de la genética en la prevención de lesiones
Está científicamente probado, que la actividad física tiene múltiples efectos positivos en nuestra salud y bienestar. Sin embargo, una práctica deportiva inadecuada, mal orientada y sin planificar; puede derivar en lesiones.
En los últimos años, el conocimiento de la influencia genética en la actividad deportiva ha evolucionado de tal manera; que se han descrito cambios genéticos (polimorfismos o SNPs) que influyen en el rendimiento y predisposición a padecer lesiones.
Si bien la causa de las lesiones es multifactorial (nutrición, estilo de vida, carga de entrenamiento, superficie, etc.), estudios
científicos estiman que el componente genético influye en valores cercanos al 50% en la condición física y psicológica del deportista.
La genética aplicada a la medicina deportiva, ofrece información predictiva fiable y objetiva, para que realices una práctica deportiva acorde a tus objetivos; mejorando tu rendimiento y evitando posibles lesiones.
El Estudio Genético permite obtener recomendaciones para mejorar el desempeño y prevenir lesiones: bienestar a largo plazo
Un estudio recomendado a:
Se recomienda que el deportista esté asesorado por un especialista o profesional, que utilice la información como herramienta complementaria; teniendo en cuenta otras variables que influyen en el rendimiento del atleta.
Prueba: 15676- TEST GENETICO DE LESIONES DEPORTIVAS
Metodología: Extracción del ADN a partir de la saliva. Análisis de 17 SNPs en 17 genes
Requisitos: Se requiere firmar el consentimiento informado y rellenar un cuestionario
Tipo de muestra: Saliva
Preparación previa: No es necesaria
Plazo de entrega: 3-4 semanas a partir de la recepción de la muestra de saliva
Recomendaciones y protocolos preventivos personalizados, basados en los resultados genéticos obtenidos y en datos personales (antropométricos, deportivos e historial de lesiones)
El estudio genético de lesionabilidad informa de la predisposición a padecer lesiones de no-contacto en tejidos blandos y del grado de severidad de dichas lesiones, además de proporcionar orientación en tiempos de recuperación.
Si bien la influencia del genoma en la predisposición a padecer lesiones deportivas está demostrada, la causa de las lesiones es multifactorial. Por ello, la información proporcionada indica predisposición y no es absoluta, no significa que se vaya o no a sufrir lesiones. Conociendo la base genética y con el asesoramiento de un especialista, se logra una actividad física equilibrada.
En el Estudio Genético de Lesiones Deportivas se analizan 17 polimorfismos genéticos (SNPs), alteraciones de una sola base en la secuencia del material genético (ADN); localizados en genes relacionados con el desarrollo, regeneración y elasticidad del tejido muscular, ligamentoso y tendinoso. Esta información genética se combina con datos antropométricos, deportivos y lesionales personales; obtenidos a partir del cuestionario, para la elaboración del informe final.
El informe final consta de: